- от автора admin
Содержание
- Изменения в понятийном аппарате
- Полномочия федеральных органов государственной власти
- Введена глава «Государственная фармакопея»
- Сфера государственного контроля за обращением
- Государственная регистрация лекарственных препаратов
- Клинические исследования лекарственных препаратов
- Производство и маркировка лекарственных средств
- Ввоз на территорию РФ и вывоз с территории РФ
- Осуществление фармацевтической деятельности
- Уничтожение лекарственных средств
- Ответственность за нарушение законодательства РФ
- Интересные материалы:
«Бюджетные учреждения здравоохранения:
бухгалтерский учет и налогообложение», 2010, N 6
С 1 сентября 2010 г. вступит в силу Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» (далее — Закон N 61-ФЗ). Он подготовлен взамен действующего в настоящее время Федерального закона от 22.06.1998 N 86-ФЗ «О лекарственных средствах» (далее — Закон N 86-ФЗ) и является базовым нормативным документом, предусматривающим комплексное правовое регулирование общественных отношений в сфере обращения лекарственных средств для медицинского и ветеринарного применения. Разработка данного Закона обусловлена необходимостью совершенствования сферы обращения лекарственных препаратов с учетом ряда принятых в российском законодательстве изменений.
Новый законодательный акт отличается от действующего Закона N 86-ФЗ структурой отдельных глав, отражающей последовательность этапов обращения лекарственных средств (от разработки лекарственного средства до мониторинга безопасности его применения) с детализацией каждого этапа. Но в первую очередь хочется отметить изменения в понятийном аппарате.
Изменения в понятийном аппарате
В соответствии с общепринятой международной практикой в Законе N 61-ФЗ уточняется и расширяется понятийный аппарат. Так, согласно новым определениям лекарственные средства подразделяются на фармацевтические субстанции и лекарственные препараты.
————————-¬
————+ Лекарственные средства +———-¬
¦ L————————- ¦
—————+—————¬ ——————+————¬
¦ Фармацевтические субстанции ¦ ¦ Лекарственные препараты ¦
L————-T—————- L—————-T————-
¦ ¦
—————+—————¬ ——————+————¬
¦Действующие вещества ¦ ¦Лекарственные средства в виде¦
¦растительного, животного, ¦ ¦лекарственных форм, ¦
¦биотехнологического или ¦ ¦применяемые для профилактики,¦
¦синтетического происхождения,¦ ¦диагностики, лечения болезни,¦
¦обладающие фармакологической ¦ ¦сохранения, предотвращения ¦
¦активностью, предназначенные ¦ ¦или прерывания беременности ¦
¦для производства и ¦ ¦ ¦
¦изготовления лекарственных ¦ ¦ ¦
¦препаратов и определяющие ¦ ¦ ¦
¦их эффективность ¦ ¦ ¦
L—————————— L——————————
Приведенная детализация лекарственных средств (вычленение лекарственных препаратов в качестве самостоятельного специфического объекта регулирования) позволит конкретизировать регуляторные требования к фармацевтическим субстанциям и к готовым лекарственным формам (лекарственным препаратам).
В качестве самостоятельных объектов регулирования выступают лекарственные препараты, лекарственное растительное сырье, общая фармакопейная статья, нормативная документация, ветеринарная аптека, контрафактные лекарственные средства, доклиническое и клиническое исследования лекарственного средства, международное многоцентровое клиническое исследование, побочное действие, серьезная нежелательная реакция, рецепт на лекарственный препарат.
Расширены основные понятия, используемые как в Законе N 86-ФЗ, так и в Законе N 61-ФЗ. Так, в соответствии со ст. 4 Закона N 61-ФЗ обращение лекарственных средств включает в себя разработку, доклинические и клинические исследования, экспертизу, государственную регистрацию, стандартизацию и контроль качества, производство, изготовление, хранение, перевозку, ввоз на территорию РФ, вывоз с территории РФ, рекламу, отпуск, реализацию, передачу, применение, уничтожение лекарственных средств.
Полномочия федеральных органов государственной власти
В гл. 2 Закона N 61-ФЗ уточняются полномочия федеральных органов государственной власти и органов государственной власти субъектов РФ в сфере обращения лекарственных средств с учетом изменений в законодательстве РФ.
Так, в соответствии со ст. 5 Закона N 61-ФЗ к полномочиям федеральных органов государственной власти в сфере обращения лекарственных средств относятся:
— проведение в Российской Федерации единой государственной политики в области обеспечения лекарственными препаратами граждан на территории РФ;
— утверждение общих фармакопейных, фармакопейных статей, издание государственной фармакопеи;
— осуществление государственного контроля и надзора;
— лицензирование производства лекарственных средств и фармацевтической деятельности в соответствии с законодательством РФ;
— организация экспертизы лекарственных средств, этической экспертизы возможности проведения клинического исследования лекарственного препарата для медицинского применения;
— выдача разрешений на проведение клинических исследований лекарственных препаратов, ведение реестра выданных таких разрешений;
— государственная регистрация лекарственных препаратов, ведение государственного реестра лекарственных средств;
— инспектирование производства лекарственных средств на соответствие правилам организации производства и контроля качества лекарственных средств, выдача заключений о соответствии производителя лекарственных средств требованиям указанных правил;
— государственная регистрация установленных производителями лекарственных препаратов предельных отпускных цен на жизненно необходимые и важнейшие лекарственные препараты и ведение государственного реестра предельных отпускных цен производителей на лекарственные препараты, включенные в Перечень жизненно необходимых и важнейших лекарственных препаратов;
— установление порядка ввоза на территорию РФ и вывоза с территории РФ лекарственных средств;
— создание советов по вопросам, связанным с обращением лекарственных средств;
— аттестация и сертификация специалистов;
— утверждение образовательных программ по подготовке специалистов;
— мониторинг безопасности лекарственных препаратов;
— участие в международном сотрудничестве;
— получение по запросам уполномоченного федерального органа исполнительной власти от органов исполнительной власти субъектов РФ, а также от субъектов обращения лекарственных средств для медицинского применения информации по вопросам установления и применения цен на лекарственные препараты и надбавок к ним;
— применение мер ответственности за нарушение законодательства РФ.
К полномочиям органов государственной власти субъектов РФ в сфере обращения лекарственных средств, помимо разработки, утверждения и реализации региональных программ обеспечения населения лекарственными препаратами, добавлены установление предельных оптовых и предельных розничных надбавок к фактическим отпускным ценам производителей лекарственных препаратов, включенных в Перечень жизненно необходимых и важнейших лекарственных препаратов, а также осуществление контроля за применением цен, реализуемых на территории субъекта РФ (ст. 6 Закона N 61-ФЗ).
Введена глава «Государственная фармакопея»
С введением данной главы впервые на законодательном уровне будет закреплен порядок разработки государственной фармакопеи на основе общих фармакопейных и фармакопейных статей на лекарственные средства.
В ст. 7 Закона N 61-ФЗ даны определения понятий «государственная фармакопея», «общая фармакопейная статья» и «фармакопейная статья».
——————————-¬
¦ Государственная фармакопея — ¦
———+ свод общих фармакопейных +———-¬
¦ ¦ и фармакопейных статей ¦ ¦
¦ L——————————- ¦
————-+———————¬ ————————-+———¬
¦ Общая фармакопейная статья ¦ ¦ Фармакопейная статья ¦
L————T———————- L————————T———-
————-+———————¬ ————————-+———¬
¦Документ, утвержденный ¦ ¦Документ, утвержденный ¦
¦уполномоченным федеральным органом¦ ¦уполномоченным федеральным органом¦
¦исполнительной власти и содержащий¦ ¦исполнительной власти и содержащий¦
¦перечень показателей качества ¦ ¦перечень показателей качества ¦
¦и (или) методов контроля качества ¦ ¦и методов контроля качества ¦
¦конкретной лекарственной формы, ¦ ¦лекарственного средства для ¦
¦лекарственного растительного ¦ ¦медицинского применения ¦
¦сырья, описания биологических, ¦ ¦ ¦
¦биохимических, микробиологических,¦ ¦ ¦
¦физико-химических, физических, ¦ ¦ ¦
¦химических и других методов ¦ ¦ ¦
¦анализа лекарственного средства ¦ ¦ ¦
¦для медицинского применения, ¦ ¦ ¦
¦а также требования к используемым ¦ ¦ ¦
¦в целях проведения данного анализа¦ ¦ ¦
¦реактивам, титрованным растворам, ¦ ¦ ¦
¦индикаторам ¦ ¦ ¦
L———————————— L————————————
Для справки. На сегодняшний день Общие фармакопейные и Фармакопейные статьи утверждены Приказом Минздравсоцразвития России от 15.10.2007 N 641 «Об утверждении фармакопейных статей».
Государственная фармакопея издается уполномоченным федеральным органом исполнительной власти за счет средств федерального бюджета и подлежит переизданию не реже одного раза в пять лет.
В период между изданиями государственной фармакопеи издаются приложения к ней, содержащие общие фармакопейные и (или) фармакопейные статьи, утвержденные после издания (переиздания) государственной фармакопеи.
В обязанности уполномоченного федерального органа исполнительной власти входит своевременное размещение данных о государственной фармакопее и приложениях к ней на официальном сайте в сети Интернет.
Разработка общих фармакопейных и фармакопейных статей и включение их в государственную фармакопею осуществляются в порядке, установленном уполномоченным федеральным органом исполнительной власти.
Разработка фармакопейной статьи на оригинальный лекарственный препарат и включение ее в государственную фармакопею в течение срока действия патентной защиты на оригинальный лекарственный препарат осуществляются с согласия разработчика лекарственного препарата либо после окончания срока действия патента на оригинальный лекарственный препарат.
Сфера государственного контроля за обращением
В гл. 4 Закона N 61-ФЗ раскрыт порядок осуществления государственного контроля за обращением лекарственных средств. Он проводится уполномоченными федеральными органами исполнительной власти и органами исполнительной власти субъектов РФ в соответствии с их полномочиями. На сегодняшний день эти функции возложены на территориальные отделения федеральных органов Росздравнадзора.
Государственный контроль в сфере обращения лекарственных средств включает в себя контроль за доклиническими и клиническими исследованиями, качеством, производством, изготовлением, хранением, ввозом на территорию РФ, перевозкой, реализацией, рекламой, применением лекарственных препаратов, уничтожением лекарственных средств и иной деятельностью в сфере обращения лекарственных средств. Заметим, что в действующем Законе N 86-ФЗ государственным контролем охвачен только процесс производства и изготовления лекарственных средств, а также их ввоз на территорию РФ.
Государственная регистрация лекарственных препаратов
Глава 6 Закона N 61-ФЗ, посвященная государственной регистрации, самая большая и в значительной степени касается производителей лекарственных средств, поэтому в качестве ознакомительного материала автор приводит только несколько моментов, которые могут быть интересны руководителям учреждений здравоохранения.
Следует обратить внимание, что данная глава содержит очень интересную и значимую для всех участников фармацевтического рынка статью, посвященную порядку ведения государственного реестра лекарственных средств. В соответствии со ст. 33 Закона N 61-ФЗ государственный реестр лекарственных средств включает перечень лекарственных препаратов, прошедших государственную регистрацию, перечень фармацевтических субстанций, входящих в состав лекарственных препаратов.
В силу п. 3 ст. 33 Закона N 61-ФЗ порядок ведения государственного реестра лекарственных средств для медицинского применения и порядок ведения государственного реестра лекарственных средств для ветеринарного применения утверждаются соответствующим уполномоченным федеральным органом исполнительной власти.
Отметим, что с целью снижения административных барьеров, препятствующих получению заявителем необходимой информации, ст. 37 Закона N 61-ФЗ закреплена обязанность уполномоченного федерального органа исполнительной власти размещать на официальном сайте в сети Интернет подробную информацию, связанную с процессом проведения государственной регистрации лекарственных препаратов, в том числе экспертизы лекарственных средств, информацию о зарегистрированных лекарственных препаратах и лекарственных препаратах, исключенных из государственного реестра лекарственных средств, не позднее чем через пять рабочих дней со дня поступления в уполномоченный федеральный орган исполнительной власти заявления о государственной регистрации лекарственного препарата.
Клинические исследования лекарственных препаратов
Отдельная глава (гл. 7) Закона N 61-ФЗ отведена клиническим исследованиям лекарственных препаратов для медицинского применения.
В соответствии со ст. 38 данного Закона клинические исследования лекарственных препаратов проводятся с целью получения научными методами оценок и доказательств эффективности и безопасности лекарственных средств, данных об ожидаемых побочных эффектах от применения лекарственных препаратов и эффектах взаимодействия с другими лекарственными препаратами.
С целью повышения инновационного потенциала отечественного здравоохранения к организации проведения клинических исследований лекарственного препарата организацией — разработчиком этого препарата могут привлекаться юридические лица любой организационно-правовой формы при условии обеспечения соответствия клинических исследований установленным требованиям (п. 6 ст. 38 Закона N 61-ФЗ).
Медицинские организации, участвующие в клинических исследованиях, должны иметь государственную аккредитацию, подтвержденную уполномоченным федеральным органом исполнительной власти в установленном законом порядке (п. 7 ст. 38 Закона N 61-ФЗ). Данные меры направлены на признание соответствия медицинских организаций требованиям, предъявляемым к проведению клинических исследований лекарственных препаратов, а также на поддержание высокого уровня проведения клинических исследований лекарственных средств на территории РФ в соответствии с требованиями надлежащей клинической практики (GCP), на обеспечение достоверности получаемых результатов и защиты прав пациентов.
Производство и маркировка лекарственных средств
Глава 8 Закона N 61-ФЗ раскрывает основные моменты производства и маркировки лекарственных средств.
Следует обратить внимание, что в соответствии с п. 8 ст. 45 Закона N 61-ФЗ производители лекарственных средств могут осуществлять продажу лекарственных средств или передавать их в установленном законодательством РФ порядке следующим участникам фармацевтического рынка:
— другим производителям лекарственных средств для производства лекарственных средств;
— организациям оптовой торговли лекарственными средствами;
— аптечным организациям, ветеринарным аптечным организациям, индивидуальным предпринимателям, имеющим лицензию на фармацевтическую деятельность или лицензию на медицинскую деятельность;
— научно-исследовательским организациям для научно-исследовательской работы;
— медицинским и ветеринарным организациям;
— организациям, осуществляющим разведение, выращивание и содержание животных.
Отметим, данный перечень расширен последними двумя участниками фармацевтического рынка, в настоящее время в ст. 28 Закона N 86-ФЗ они не включены. Это обусловлено тем, что медицинские организации с 01.09.2010 могут напрямую заключать государственные контракты на поставку с производителями лекарственных средств, минуя оптовые и аптечные организации.
В ст. 46 Закона N 61-ФЗ раскрыт порядок маркировки лекарственных средств, который приведен в соответствие мировым стандартам.
Ввоз на территорию РФ и вывоз с территории РФ
Глава 9 Закона N 61-ФЗ регулирует порядок ввоза на территорию РФ и вывоза с территории РФ лекарственных средств. Как и Закон N 86-ФЗ, новый Закон регламентирует, что ввоз лекарственных средств на территорию РФ осуществляется в порядке, установленном Правительством РФ <*>, в соответствии с Федеральным законом от 08.12.2003 N 164-ФЗ «Об основах государственного регулирования внешнеторговой деятельности».
<*> Утвержден Постановлением Правительства РФ от 16.07.2005 N 438.
Все ввозимые на территорию РФ лекарственные средства должны быть включены в государственный реестр лекарственных средств. Однако п. 3 ст. 47 Закона N 61-ФЗ допускается ввоз на территорию РФ конкретной партии незарегистрированных лекарственных средств, предназначенных для оказания медицинской помощи по индивидуальным жизненным показаниям пациента. Срок оформления разрешительных документов на ввоз незарегистрированных лекарственных средств по приведенным выше основаниям и выдачи этих документов не должен превышать пяти рабочих дней. Плата за выдачу указанных документов не взимается.
Статьей 48 Закона N 61-ФЗ конкретизирован список юридических лиц, которым разрешен ввоз лекарственных средств на территорию РФ. Лекарственные средства могут ввозить:
— производители лекарственных средств для целей собственного производства лекарственных средств;
— иностранные разработчики лекарственных средств и иностранные производители лекарственных средств или другие юридические лица по поручению разработчика лекарственного средства для проведения клинических исследований лекарственного препарата, осуществления государственной регистрации лекарственного препарата, включения фармацевтической субстанции в государственный реестр лекарственных средств, контроля качества лекарственных средств при наличии разрешения уполномоченного федерального органа исполнительной власти на ввоз конкретной партии лекарственных средств;
— организации оптовой торговли лекарственными средствами;
— научно-исследовательские организации, образовательные учреждения высшего профессионального образования, производители лекарственных средств для разработки, исследований, контроля безопасности, качества, эффективности лекарственных средств при наличии разрешения уполномоченного федерального органа исполнительной власти;
— медицинские организации, иные указанные в п.п. 1-4 названной статьи организации для оказания медицинской помощи по жизненным показаниям конкретного пациента при наличии разрешения уполномоченного федерального органа исполнительной власти на ввоз конкретной партии лекарственного препарата, выданного в установленном порядке в форме электронного документа, подписанного электронной цифровой подписью.
Обратите внимание! На территорию РФ можно ввозить лекарственные средства, качество которых подтверждено сертификатом производителя лекарственных средств, удостоверяющим соответствие ввозимых лекарственных средств требованиям фармакопейных статей либо в случае их отсутствия нормативной документации или нормативного документа. Ввоз на территорию РФ фальсифицированных, недоброкачественных, контрафактных лекарственных средств запрещен (п.п. 4-5 ст. 47 Закона N 61-ФЗ).
Осуществление фармацевтической деятельности
Законом N 61-ФЗ усовершенствованы нормы в части осуществления фармацевтической деятельности. В соответствии со ст. 52 данного Закона фармацевтическая деятельность осуществляется:
1) организациями оптовой торговли лекарственными средствами;
2) аптечными организациями;
3) ветеринарными аптечными организациями;
4) индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность;
5) медицинскими организациями, имеющими лицензию на фармацевтическую деятельность, и их обособленными подразделениями (амбулаториями, фельдшерскими и фельдшерско-акушерскими пунктами, центрами (отделениями) общей врачебной (семейной) практики), расположенными в сельских поселениях, в которых отсутствуют аптечные организации;
6) ветеринарными организациями, имеющими лицензию на фармацевтическую деятельность.
Розничная торговля лекарственными препаратами. Следует обратить внимание на существенные изменения, которые вносятся Законом N 61-ФЗ в правила розничной торговли лекарственными препаратами.
Пунктом 1 ст. 55 Закона N 61-ФЗ разрешена розничная продажа лекарственных препаратов населению непосредственно в медицинских организациях и их обособленных подразделениях (центрах (отделениях) общей врачебной (семейной) практики, амбулаториях, фельдшерских и фельдшерско-акушерских пунктах), имеющих лицензию на фармацевтическую деятельность, расположенных в сельских поселениях, в которых отсутствуют аптечные организации. Таким образом, данная норма существенно повысит доступность лекарственных препаратов для сельского населения.
Изготовление и отпуск лекарственных препаратов. Внесены уточнения в порядок изготовления и отпуска лекарственных средств аптечными учреждениями. В соответствии с п. 2 ст. 56 Закона N 61-ФЗ при изготовлении лекарственных препаратов аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, используются фармацевтические субстанции, включенные соответственно в государственный реестр лекарственных средств для медицинского применения и государственный реестр лекарственных средств для ветеринарного применения в установленном порядке.
Маркировка лекарственных препаратов, изготовленных аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, и оформление таких препаратов должны соответствовать правилам изготовления и отпуска лекарственных препаратов, утвержденным уполномоченным федеральным органом исполнительной власти (п. 3 ст. 56 Закона N 61-ФЗ).
Обратите внимание! Не допускается изготовление аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, лекарственных препаратов, зарегистрированных в Российской Федерации (п. 2 ст. 56 Закона N 61-ФЗ).
Хранение лекарственных средств. Руководителям учреждений здравоохранения следует обратить внимание на ст. 58 Закона N 61-ФЗ, регламентирующую порядок хранения лекарственных средств. Согласно данной статье правила хранения лекарственных средств утверждаются соответствующим уполномоченным федеральным органом исполнительной власти.
Существует пока единственный нормативный документ, которым утверждены Правила хранения наркотических средств и психотропных веществ, — Постановление Правительства РФ от 31.12.2009 N 1148. Судя по тому, что изменены требования к хранению лекарственных средств, представляется, что должен появиться соответствующий нормативный акт, содержащий регламентации по их хранению.
Уничтожение лекарственных средств
Уничтожению лекарственных средств в Законе N 61-ФЗ посвящена отдельная гл. 11, которая состоит из одной ст. 59. В ней следует обратить внимание на несколько моментов.
Во-первых, как и в соответствии с действующими нормами ст. 31 Закона N 86-ФЗ, недоброкачественные, фальсифицированные лекарственные средства подлежат изъятию из гражданского оборота и уничтожению в порядке, установленном Правительством РФ. Их реализация запрещена. Основанием для уничтожения лекарственных средств является решение владельца лекарственных средств, решение соответствующего уполномоченного федерального органа исполнительной власти или решение суда.
Во-вторых, подлежат изъятию и уничтожению по решению суда все контрафактные лекарственные средства. Порядок их уничтожения устанавливается Правительством РФ.
В-третьих, все расходы, связанные с уничтожением контрафактных, недоброкачественных и фальсифицированных лекарственных средств, возмещаются их владельцем. Для этого он должен представить в уполномоченный федеральный орган исполнительной власти документ или заверенную в установленном порядке его копию, подтверждающие факт уничтожения лекарственных средств. Соответствующий уполномоченный федеральный орган исполнительной власти, принявший решение об уничтожении лекарственных средств, осуществляет контроль за их уничтожением.
В-четвертых, уничтожение лекарственных средств производится организациями, имеющими соответствующую лицензию, на специально оборудованных площадках, полигонах и в специально оборудованных помещениях с соблюдением требований в области охраны окружающей среды согласно законодательству РФ.
Наркотические, психотропные и радиофармацевтические лекарственные средства уничтожаются в соответствии с законодательством РФ.
Ответственность за нарушение законодательства РФ
Руководителям учреждений здравоохранения следует обратить внимание на ст. 69 Закона N 61-ФЗ, которая устанавливает порядок возмещения вреда, причиненного пациенту вследствие применения лекарственного препарата, пришедшего в негодность в результате нарушения правил хранения лекарственных средств, правил изготовления и отпуска лекарственных препаратов.
Возмещение вреда осуществляется медицинской организацией, имеющей лицензию на фармацевтическую деятельность (ее обособленным подразделением (амбулаторией, фельдшерским и фельдшерско-акушерским пунктами, центром (отделением) общей врачебной (семейной) практики), расположенным в сельском поселении, в котором отсутствует аптечная организация), допустившей продажу или отпуск указанного лекарственного препарата.
Эксперт журнала
«Бюджетные учреждения здравоохранения:
бухгалтерский учет и налогообложение»
С.ВАЛОВА
Подписано в печать
В хозрасчетных аптеках различают централизованный, децентрализованный и смешанный бухгалтерский учет. При централизованном учете в аптеках и других аптечных учреждениях оформляется первичная документация, данные которой регистрируются в течение месяца в накопительных ведомостях: рецептурном журнале, журнале розничных оборотов, кассовой книге и т. д.
Вся учетная обработка первичной документации ведется в соответствии с инструкцией, утвержденной Министерством здравоохранения. Аптеки, ведущие централизованный, первичный учет, находятся на балансе вышестоящей организации, которой они представляют свою отчетность с приложенными оправдательными документами для отражения этой документации в бухгалтерском балансе вышестоящей организации.
Децентрализованный учет предусмотрен для крупных аптек, ведущих бухгалтерский учет, составляющих самостоятельно баланс и имеющих расчетные счета в банке. При таком учете аптека передает в аптечное управление законченный бухгалтерский баланс. В том случае, если аптечное учреждение (например, Центральная районная аптека — ЦРА) само ведет балансовый учет, а подчиненные ей аптеки сдают в бухгалтерию ЦРА первичный, низовой отчет, образуется смешанный характер учета.
Для выполнения учетных операций в штатах аптек предусмотрены должности старших бухгалтеров, бухгалтеров. В аптеках VI категории учет ведет заведующий. В административном отношении счетные работники подчиняются заведующему аптекой. В методологическом отношении, т. е. в отношении правильности ведения всех учетных операций, руководящим органом для них является бухгалтерия вышестоящей организации.
Счетные работники вместе с заведующим аптекой несут ответственность за качество учетно-отчетной документации. Все учетные операции они ведут согласно инструкциям, по утвержденным формам и образцам. Основная цель учета в аптеке — обеспечить укрепление хозяйственного расчета, устранить непроизводительные потери, использовать учет для рационального ведения хозяйства и выявления неиспользованных резервов.
Руководствуясь общими принципами ведения учета (статистического, оперативно-технического и бухгалтерского) и соответствующими приказами, инструкциями и положениями, счетные работники аптек обязаны выполнять следующую работу:
1) правильно отражать в учетной документации торговую, производственную, финансовую и хозяйственную деятельность аптеки в соответствии с утвержденным планом;
2) обеспечить документальный контроль за сохранностью оборудования, инвентаря, товарно-материальных ценностей и денежных средств, принадлежащих аптеке или находящихся в ее распоряжении;
3) путем четко организованного учета и отчетности предупреждать хищения и растраты в аптеках;
4) систематически контролировать соблюдение штатной, финансовой и кассовой дисциплины, проверять выполнение всех обязательств перед государственным бюджетом, а также следить за своевременным проведением различных платежей;
5) проверять законность и целесообразность различных расходов и устанавливать соответствие их утвержденным нормам и сметам;
6) своевременно вскрывать отклонения от плановых заданий, выявлять недостатки в работе и способствовать их устранению;
7) составлять и представлять в вышестоящие организации первичные отчеты или законченные балансы в установленные сроки и в соответствии с утвержденными формами;
8) давать точный анализ всей деятельности аптеки и определять результаты ее работы за квартал или год.
Для небольших по объему работы аптек окончательные результаты хозяйственно-финансовой деятельности выводятся вышестоящей организацией и сообщаются аптекам ежеквартально.
Правильная организация первичного учета заключается в четком оформлении оправдательного документа и своевременном занесении и отражении его в учетных журналах, книгах, ведомостях и т. д.
Одним из важных вопросов организации учета в аптечных учреждениях является четкое определение лиц, несущих материальную ответственность за товарно-материальные ценности и денежные средства. Для каждого материально ответственного лица устанавливается перечень ценностей, за которые он отвечает, и организуется учет за движением этих ценностей.
Объектами учета в хозрасчетных аптеках являются хозяйственные средства и их составные части, расчеты с различными организациями и лицами, затраты труда и расчеты по заработной плате.
Любое поступление товаров и ценностей, а также каждый вид расходования их обязательно сопровождается оправдательным документом, который служит основанием для оформления учетных операций.
Важным условием точности учета является правильная оценка товаров и ценностей, при оприходовании и списании в расход, для чего необходимо руководствоваться утвержденными розничными и оптовыми ценами.
Лучшей организации учета товарно-материальных ценностей способствуют следующие мероприятия:
1) правильное размещение различных групп товаров и материальных ценностей по отделам аптеки с таким расчетом, чтобы можно было легко проверить их при инвентаризации;
2) использование в учете единой номенклатуры шифров на товар;
3) документальное оформление каждого поступления и отпуска товарно-материальных ценностей по каждому материально ответственному лицу;
4) применение в крупных аптеках вычислительных машин для механизации учета и отчетности.
Переход товарно-материальных ценностей от одного лица к другому должен сопровождаться документальным оформлением за подписями лиц, передавших и принявших ценности.
Управленческая деятельность тесно связана с работой с документами. Принятие и выработка управленческих решений происходит на базе полученной и (или) переработанной информации, носителем которой служит документ на бумажной основе.
Документ – объект труда в сфере управления – является материальным объектом с информацией, закрепленной созданным человеком способом ее передачи во времени и пространстве.
Документ выполняет:
· общие функции:
– информационные – любой документ создается для хранения информации
либо для необходимости зафиксировать информацию;
– социальные – документ является социально значимым объектом,
поскольку документ может быть порожден той или иной социальной
потребностью;
– коммуникативные – документ выступает в качестве средства связи между
отдельными элементами общественной структуры, в частности между
организациями (предприятиями, учреждениями);
– культурные – документ является средством закрепления и передачи
культурных традиций, что лучше всего прослеживается на больших
комплектах документов, например в научно-технической документации
находит отражение уровень научного и технического развития общества;
· специфические функции:
– управленческие – документ является инструментом управления (плановые
документы, отчетные, организационно-распорядительные и др.),
специально создаваемые для реализации целей управления;
– правовые – документ является средством закрепления и изменения
правовых норм и правоотношений в обществе (законодательные и
правовые нормативные акты, изначально создаваемые для фиксации
правовых норм и правоотношений, а также документы, приобретающие
правовую функцию на время, например в качестве доказательства может
использоваться любой документ);
– функция исторического источника – документ выступает в качестве
источника исторических сведений; эту функцию приобретает только
часть создаваемых документов (примерно 12-14%) и только после того,
как документы выполнят свои оперативные функции и поступят на
хранение в архив.
Совокупность процессов создания и обработки всех документов в организации (предприятии, учреждении) предполагает наличие определенных норм и требований к составлению и оформлению документов, порядку работы с ними, их обработке, движению, хранению, иначе говоря системы документирования.
Документы, обеспечивающие организацию и функционирование аптечных предприятий, подразделяют на 3 группы:
1) организационные (инструкции, положения, правила, уставы и др.);
2) распорядительные (приказы, решения и др.);
3) справочно-информационные (служебные письма, докладные и объяснительные записки, протоколы и др.).
Иногда выделяют еще документы по личному составу (приказы, заявления и др.).
Состав и количество документов в различных организациях (предприятиях, учреждениях) определяется кругом вопросов и порядком их разрешения, а также объемом и характером прав организации (предприятия, учреждения) и его взаимосвязи с другими организациями (предприятиями, учреждениями).
Требования к оформлению документов содержит Государственный стандарт РФ ГОСТ Р 6.30-2003 Унифицированные системы документации «Унифицированная система организационно-распорядительной документации. Требования к оформлению документов». Стандарт устанавливает: состав реквизитов документов; требования к оформлению реквизитов документов, включая бланки документов с воспроизведением Государственного герба Российской Федерации.
Всякий отдельный документ включает в себя ряд составляющих его элементов, которые называются реквизитом (наименование вида, автор, адресат, заголовок и т.д.). Совокупность реквизитов, определенным образом расположенных в документе, составляет формуляр этого документа. Для конкретного вида документа, например приказа, протокола акта, характерен свой формуляр, который называется типовым формуляром. ГОСТ 6.30-2003 перечисляет в определенной последовательности реквизиты, присущие всем видам документов, входящих в унифицированную систему организационно-распорядительной документации. Всего ГОСТом предусмотрено 30 реквизитов.
Стандарт дает максимальный набор реквизитов, которые могут встретиться при составлении и оформлении документов. В конкретном документе реквизитов будет меньше.
Существуют два способа расположения реквизитов: продольный и угловой.
При продольном расположении реквизитов название организации (предприятия, учреждения) размещается вдоль верхнего поля документов, а при угловом – у границы левого поля в верхнем углу. Наиболее экономичным (по использованию площади листа) и удобным (для обработки) является угловой способ. Большинство служебных документов оформляется на бумаге формата А4 (210 х 297) и А5 (148 х 210).
Служебные документы оформляются на бланках, под которыми понимается стандартный лист бумаги с воспроизведенной на нем постоянной информацией и местом, отведенным для переменной информации. Бланк должен быть отпечатан в типографии.
В ГОСТ 6.30-2003 приведены размеры полей бланков: левое – 20 мм; верхнее – не менее 20 мм; правое – не менее 10 мм; нижнее – не менее 20 мм.
Подробное описание к каждому реквизиту в отдельности дано в ГОСТ 6.38-90.
Введение. Стремительное расширение сети аптек заставляет всех участников розничной торговли фармацевтической продукции задуматься о том, как укрепить свои позиции на рынке. При этом выживают наиболее приспособленные – те, кто смогут предоставить наиболее качественные услуги по самым приемлемым для потребителей ценам, и те, кто совершенствуют уровень обслуживания клиентов .
Современный фармацевтический рынок насыщен огромным количеством самых разнообразных предложений о предоставлении услуг. Услуги могут быть направлены на различные целевые аудитории, на различные объекты, различаться по степени осязаемости . Поэтому в процессе деятельности аптечного учреждения необходимо использование результатов маркетинга услуг – области маркетинга, представляющего собой комплексную деятельность по изучению потребительского спроса, конкретных рынков, созданию конкурентоспособной услуги, доведению этой услуги до потребителя. Маркетинг услуг имеет двойную цель: увеличить прибыль компании, предоставляющей услуги, и удовлетворить потребительский спрос на ту или иную услугу .
Среди научных трудов, тесно связанных с направлением исследований, значимое место занимают работы и др. Однако на сегодняшний день проблема поддержания конкурентных преимуществ аптечных учреждений за счет предоставления качественных услуг и постоянного совершенствования уровня обслуживания клиентов становится одной из наиболее значимых для благополучия аптек и требует дальнейшего изучения.
Целью статьи является анализ сервисного обслуживания аптек Украины с позиций маркетинга услуг.
Материалы и методы исследования. С целью анализа уровня сервиса, сферы услуг аптечных учреждений Украины и определения их социально-экономического значения использованы полевые исследования. Проведен опрос покупателей аптек.
Результаты и их обсуждение. Услуга – это объект продажи, являющийся полезным действием . Услуги делятся на три группы: услуги, связанные с товаром; услуги, основанные на использовании оборудования; услуги, основанные на труде человека. Услуги, связанные с товаром, выполняют дополнительную роль при продаже товара. Например, обслуживание изделий медицинской техники (ИМТ) после продажи. Услуги, основанные на использовании оборудования, – это услуги, для оказания которых применяют оборудование. Например, измерение в аптеке артериального давления, измерение уровня сахара в крови. Услуги, основанные на труде человека, – услуги специалистов (провизора/фармацевта, врача) .
Для исследования состояния сервиса и сферы услуг аптечных учреждений нами было проведено анкетирование потребителей аптек Харьковской, Кировоградской, Донецкой, Полтавской, Днепропетровской, Луганской, Львовской, Волынской областей. Обработано 115 анкет потребителей. Среди опрошенных потребителей большинство составили женщины (52%) в возрасте 21-30 лет.
Установлено, что 61% респондентов посещают аптеки по мере необходимости, 25% – 2-3 раза в неделю. Для большинства опрошенных посетителей (72%) график работы аптеки является удобным.
В ходе исследований установлено, что 73% опрошенных потребителей положительно оценивают качество и оперативность обслуживания персоналом аптеки, что свидетельствует о высоком уровне профессионализма провизоров/фармацевтов.
К задачам специалиста относится помощь в выборе лекарственного препарата (ЛП), консультация по его рациональному применению, оказание первой неотложной помощи при неукоснительном выполнении правил профессиональной этики и деонтологии. Установлено отношение потребителей к рекомендациям провизора/фармацевта при покупке лекарственного средства (ЛС): 60% респондентов пользуются рекомендациями специалиста при выборе ЛС для самолечения, но окончательный выбор оставляют за собой; 26% покупателей всегда пользуются рекомендациями специалиста. Только 14% опрошенных считают нужным обращаться за консультацией к специалисту.
Все практикующие провизоры/фармацевты обязаны гарантировать, что услуги, которые они предоставляют каждому потребителю, имеют надлежащее качество. Поэтому утверждение в Украине протоколов провизора/фармацевта является своевременным и результативным шагом в направлении создания национальных стандартов аптечного дела . При покупке ЛП необходимо повышение эффективности и безопасности лекарственной терапии конкретного больного – обеспечение каждому больному надлежащего качества фармацевтической опеки.
Для того чтобы определить уровень обслуживания в соответствии со стандартами (протоколами провизора/фармацевта), нами подготовлены анкеты для потребителей, содержащие вопросы по различным аспектам обслуживания.
В результате обработки анкет получены следующие данные: в 43% случаев провизор просто отпускает ЛС без предоставления дополнительной информации; в 42% – провизор рекомендует обратиться к врачу; в 35% – провизор спрашивает о симптомах заболевания; у 14% – спрашивает о том, какие ЛП уже принимаются и предоставляет информацию о применении ЛП с пищей; у 10% – дает письменные инструкции по приему ЛП; у 8% – предоставляет информацию о взаимодействии между ЛП.
Проанализировав анкеты потребителей, можно сделать вывод, что работники аптек не в полной мере выполняют протоколы провизора/фармацевта. В большинстве случаев происходит просто отпуск ЛП. Они не всегда интересуются тем, какие ЛП уже принимаются, не предоставляют необходимой информации о взаимодействии между различными препаратами при их совместном применении, о взаимодействии между ЛП и продуктами питания, никотином, алкоголем. И только небольшое количество специалистов проводит качественную фармацевтическую опеку при отпуске препаратов населению.
С целью выявления уровня сервиса проведен анализ структуры услуг, предоставляемых в аптеке, и степени их распространенности (рис. 1).
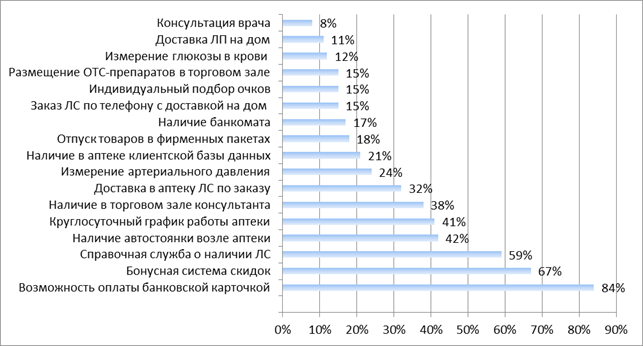
Рис. 1. Предоставление услуг в аптеке
В ходе исследований установлено, что в большинстве аптек (84%) клиенты могут осуществлять оплату банковской картой. В рамках программы лояльности клиентов 67% аптек употребляют бонусную систему скидок; 59% аптечных учреждений имеют справочную службу о наличии ЛС в аптеке; 42% – имеют автостоянку; 41% – работают круглосуточно. В 38% аптек в торговом зале есть провизор-консультант. 32% аптек предоставляют услугу доставки ЛС в аптеку по предварительному заказу клиентов. В 24% аптек посетителям измеряют артериальное давление; 21% аптек имеют клиентскую базу данных.
На следующем этапе исследований потребители оценили важность для них каждой из имеющихся в аптеке услуг по 10-балльной шкале (табл. 1): профессиональные советы провизора (9,9 балла) занимают первое место в работе аптеки, поскольку провизор несет ответственность перед каждым покупателем по результатам лечения, начиная от момента отпуска лекарств и до полного окончания их действия; доставка в аптеку ЛС по заказу (9,3 балла) – эта услуга дает возможность потребителю заказать препарат, которого не было в ассортименте аптеки; справочная служба о наличии ЛС в аптеке (8,8 балла) – услуга, позволяющая получить информацию о наличии препарата, его цене и позволяет сэкономить время; круглосуточный график работы аптеки (8,6 балла) – предоставляет возможность приобрести лекарства в удобное для клиента время; возможность осуществлять оплату банковской карточкой (7,9 балла) – услуга аптеки, позволяющая выбрать удобную для покупателя форму расчета; бонусная система скидок (7,9 балла) – услуга аптеки, позволяющая увеличить количество постоянных клиентов и привлекать новых; консультация врача (7,8 балла), измерение артериального давления (7,6 балла), измерение глюкозы в крови (7,5 балла) – услуги, позволяющие увеличить количество покупателей; доставка лекарств на дом (7,4 балла) и заказ ЛС по телефону с доставкой на дом (7,3 балла) – позволяют экономить время и покупать препараты людям с ограниченной подвижностью; наличие в торговом зале провизора-консультанта (7,1 балла) – позволяет потребителю правильно подобрать косметические средства, средства гигиены и т.д.; отпуск ЛП в бесплатных фирменных пакетах (6,7 балла) – оставляет впечатление о посещении аптеки; размещение безрецептурных препаратов в торговом зале по типу супермаркета (6,6 балла) – услуга, позволяющая выбрать товар самостоятельно, если нет необходимости консультации провизора/фармацевта; наличие отдела оптики (6,6 балла) – услуга, которая предоставляет возможность подбора очков; наличие в аптеке клиентской базы данных (6,6 балла) – услуга, направленная на разработку программ лояльности клиентов, которая позволяет не только привлечь новых покупателей, но и значительно повысить качество взаимодействия с постоянными клиентами, что поможет определять их потребности и отслеживать количество совершенных покупок; наличие банкомата (6,5 балла) – услуга, способствующая привлечению случайных клиентов; наличие автостоянки возле аптеки (6,4 балла) – обеспечивает удобство посещения аптеки для людей, пользующихся личным автотранспортом.
Таблица 1
Оценка важности услуг, связанных с отпуском ЛС
|
Название услуги |
Оценка (по 10-балльной шкале) |
|
Профессиональные советы провизора |
9,9 |
|
Доставка в аптеку ЛС по заказу |
9,3 |
|
Справочная служба о наличии ЛС |
8,8 |
|
Круглосуточный график работы аптеки |
8,6 |
|
Возможность осуществлять оплату банковской карточкой |
7,9 |
|
Бонусная система скидок |
7,9 |
|
Доставка ЛП на дом |
7,4 |
|
Заказ ЛС по телефону с доставкой на дом |
7,3 |
|
Наличие в торговом зале провизора-консультанта |
7,1 |
|
Отпуск товаров в фирменных пакетах (бесплатно) |
6,7 |
|
Наличие в аптеке клиентской базы данных |
6,6 |
|
Размещение ОТС-препаратов в торговом зале |
6,6 |
Была проведена оценка важности для посетителей аптек услуг, связанных с отпуском ИМН и косметических средств (КС) (табл. 2).
Таблица 2
Оценка важности услуг, связанных с отпуском ИМН и КС
|
Название услуги |
Оценка (по 10-балльной шкале) |
|
Индивидуальный подбор предметов ухода за больными |
8,6 |
|
Сервисное обслуживание изделий медицинской техники |
8,4 |
|
Консультация провизора по использованию изделий медицинской техники |
|
|
Консультация провизора-косметолога в отделе косметических и гигиенических средств |
7,6 |
Среди услуг, связанных с отпуском ИМН и КС, наибольшее значение имеют: индивидуальный подбор предметов ухода за больными (8,6), сервисное обслуживание изделий медицинской техники (8,4), консультация провизора-косметолога в отделе КС (7,6).
Выводы и перспективы дальнейших научных исследований
- В результате проведенного опроса покупателей в аптеках Украины относительно исследования состояния сервиса, сферы услуг аптечных учреждений и определения их социально-экономического значения установлено, что 73% опрошенных положительно оценивают качество и оперативность обслуживания персоналом аптеки.
- В ходе исследований установлено, что 60% респондентов пользуются рекомендациями специалиста при выборе ЛС для самолечения, но окончательный выбор оставляют за собой.
- Результаты исследования показали, что работники аптек не в полной мере выполняют протоколы провизора/фармацевта, в основном без предоставления дополнительной информации о ЛС.
- В ходе исследований установлено, что наиболее важными для покупателей являются такие услуги: профессиональные советы провизора, доставка в аптеку ЛС по заказу, справочная служба о наличии ЛС, круглосуточный график работы аптеки, бонусная система скидок и др.
- Полученные результаты могут быть применены в практической деятельности аптечных учреждений с целью повышения уровня сервисного обслуживания и расширения сферы предоставляемых услуг, влияющих, с одной стороны – на рост товарооборота, а с другой – на формирование положительного имиджа аптеки.
Рецензенты:
Интересные материалы:
- Экспертная организация ООО лабораторная практика
ООО "Лабораторная практика" - организация, выполняющая функции экспертной организации, главной целью которой является обеспечение деятельности…
- Закона РСФСР об охране окружающей природной среды
Закон призван способствовать формированию и укреплению экологического правопорядка и обеспечению экологической безопасности на территории РФ…
- Принятие закона о всеобщей воинской повинности
Организованное привлечение граждан на военную службу в советское время берёт свое начало с 1918 г.,…
- Электронные деньги определение
Российский бухгалтер, N 12, 2011 годКарина Либерман,шеф-редактор журнала Что такое "электронные деньги"? Электронные деньги -…
- Ст 77 федерального закона
При увольнении по п. 6 ст. 77 ТК РФ из-за смены собственника (я не согласен…